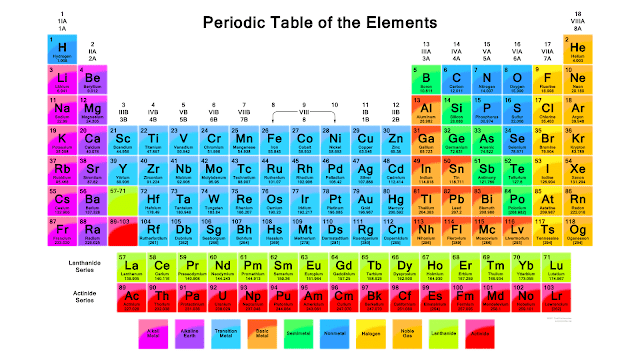
A. Periode dan Golongan
Sistem periodik yang dipakai sekarang adalah sistem periodik modern (sistem periodik bentuk panjang) yang disusun berdasarkan kenaikan nomor atom dan kemirifan sifat. Sistem periodik ini terbagi atas periode dan golongan. Golongan dapat diartikan sebagai elektron valensi yang dimiliki atom, sedangkan Periode dapat diartikan sebagai nomor kulit terbesar yang dimiliki atom. Sistem periodik modern terdiri dari 7 periode dan 8 golongan A (IA sampai VIIIA) dan 8 golongan B (IB sampai VIIIB).
- Periode 1 berisi 2 unsur,
- Periode 2 berisi 8 unsur,
- Periode 3 berisi 8 unsur,
- Periode 4 berisi 18 unsur,
- Periode 5 berisi 18 unsur,
- Periode 6 berisi 32 unsur,
- Periode 7 berisi 23 unsur, (belum lengkap).
Sedangkan penamaan Golongan dalam sistem periodeik unsur modern adalah sebagai beikut ini
- Golongan IA dinamakan Logam Alkali - (kecuali H)
- Golongan IIA dinamakan Logam Alkali Tanah
- Golongan antara IIA dan IIIA dinamakan Logam Transisi
- Golongan IIIA dinamakan Boron
- Golongan IVA dinamakan Karbon
- Golongan VA dinamakan Nitrogen
- Golongan VIA dinamakan Oksigen
- Golongan VIIA dinamakan Halogen
- Golongan VIIIA dinamakan Gas Mulia
B. Sifat-sifat Sistem Periodik Unsur
a. Jari-jari atom
Jari-jari atom adalah jarak dariintiatom sampailintasan elektron terluarnya. Besarnya jari-jari atom berdasarkan sistem periodik unsur adalah sebagai berikut:
- Pada satu periode dari kiri ke kanan: jari-jari atom berkurang. Hal ini disebabkan oleh muatan inti bertambah positif sedangkan elektron-elektron yang bertambah jumlahnya masih menempati kulit yang sama. Keadaan ini mengakibatkan gaya tarik menarik antara inti dengan elektron semakin kuatsehingga jari-jari atom makin kecil.
- Pada satu golongan dari atas ke bawah: jari-jari atom bertambah. Hal ini disebabkan oleh jumlah kulit semakin banyak walaupun muatan inti bertambah. Keadaan ini mengakibatkan gaya tarik menarik antara inti dengan elektron semakin lemah sehingga jari-jari atom bertambah besar.
b. Energi ionisasi (potensial ionisasi)
Energi ionisasi adalah energi yang diperlukan untuk melepaskan satu elektron paling luar dari suatu atom atau ion dalam fase gas. Terdapat tiga faktor yang mempengaruhi energi ionisasi, yaitu:
- Jari-jari atom: semakin besar jari-jari atom maka energi ionisasi semakin kecil.
- Muatan inti positif: semakin besar muatan inti, semakin besar energi ionisasi.
- Jumlah elektron pada kulit dalam: semakin besar jumlah elektron pada kulit dalam maka energi ionisasi semakin kecil.
Besarnya energi ionisasi berdasarkan sistem periodik unsur adalah sebagai berikut:
- Pada satu periode dari kiri ke kanan: energi ionisasi bertambah. Hal ini disebabkan oleh muatan inti bertambah positif dan jari-jari atom semakin kecil. Keadaan ini mengakibatkan gaya tarik menarik antara inti dengan elektron kulit terluar semakin kuat sehingga energi ionisasi semakin besar.
- Pada satu golongan dari atas ke bawah: energi ionisasi berkurang. Hal ini disebabkan oleh semakin besarnya jari-jari atom walaupun muatan inti bertambah. Keadaan ini mengakibatkan gaya tarik menarik antara inti dengan elektron terluar semakin lemah sehingga energi ionisasi semakin kecil.
c. Afinitas elektron (AE)
Afinitas elektron, yaitu energi yang diperlukan untuk menambahkan satu elektron pada satu atom netral dalam fase gas sehingga terbentuk ion negatif (kecuali unsur alkali tanah dan gas mulia). Energi yang terlibat dapat merupakan penyerapan energi (AE positif) atau pelepasan energi (AE negatif).
- Penyerapan energi berarti ion negatif yang terbentuk memiliki energi lebih tinggi sehingga bersifat kurang stabil. Semakin positif harga AE suatu atom berarti atom tersebut semakin sulit menerima elektron dan membentuk ion negatif.
- Pelepasan energi berarti ion negatif yang terbentuk memiliki energi lebih rendah sehingga bersifat lebih stabil. Semakin negatif harga AE suatu atom berartiatom tersebut semakin mudah menerima elektron dan membentuk ion negatif.
Pada umumnya atom-atom dengan jari-jari relatif kecil akan lebih mudah menerima elektron sehingga akan membebaskan energi yang lebih besar dibandingkan dengan atom-atom yang berjari-jari lebih besar. Besarnya afinitas elektron berdasarkan sistem periodik unsuradalah sebagai berikut:
- Pada satu periode dari kiri ke kanan: afinitas elektron cenderung bertambah. Hal ini disebabkan oleh muatan inti bertambah positif dan jari-jari atom berkurang. Keadaan ini mengakibatkan gaya tarik inti terhadap elektron yang ditambahkan semakin kuat sehingga afinitas elektron semakin besar.
- Pada satu golongan dari atas ke bawah: afinitas elektron cenderung berkurang. Hal ini disebabkan oleh jumlah elektron di kulit dalam semakin banyak walaupun muatan inti bertambah besar. Keadaan ini mengakibatkan gaya tarik inti terhadap elektron yang ditambahkan semakin lemah sehingga afinitas elektron semakin berkurang.
d. Keelektronegatifan atau elektronegativitas
Keelektronegatifan adalah suatu ukuran kemampuan atom untuk menarik elektron dalam suatu ikatan kimia.Makin besar harga keelektronegatifan berarti kemampuan atom untuk menarik elektron semakin besar, demikian pula sebaliknya. Besarnya keelektronegatifan berdasarkan sistem periodik unsur adalah sebagai berikut:
- Pada satu periode dari kiri ke kanan: keelektronegatifan bertambah. Hal ini disebabkan oleh muatan inti bertambah positif dan jari-jari atom berkurang. Keadaan ini mengakibatkan gaya tarik inti terhadap elektron semakin kuat sehingga keelektronegatifan bertambah besar.
- Pada satu golongan dari atas ke bawah:keelektronegatifan berkurang. Hal ini disebabkan oleh jumlah elektron di kulit dalam semakin banyak walaupun muatan inti bertambah positif sehingga jari-jari atom bertambah besar. Keadaan ini mengakibatkan gaya tarik inti terhadap elektron semakin lemah sehingga keelektronegatifan berkurang.
e. Sifat logam
Sifat logam berhubungan dengan kemampuan atom untuk membentuk ion positif. Besarnya sifat logam berdasarkan sistem periodik unsuradalah sebagai berikut:
- Pada satu periode dari kiri ke kanan: sifat logam berkurang. Hal ini disebabkan oleh jari-jari atom berkurang sehingga atom makin sukar melepaskan elektron untuk membentuk ion positif.
- Pada satu golongan dari atas ke bawah: sifat logam bertambah. Hal ini disebabkan oleh jari-jari atom bertambah sehingga atom makin mudah melepaskan elektron untuk membentuk ion positif.
f. Sifat nonlogam
Sifat nonlogam berhubungan dengan kemampuan atom untuk membentuk ion negatif. Besarnya sifat nonlogam berdasarkan sistem periodik unsur adalah sebagai berikut:
- Pada satu periode dari kiri ke kanan: sifat non logam bertambah. Hal ini disebakan oleh jari-jari atom berkurang sehingga atom makin mudah menarik elektron untuk membentuk ion negatif.
- Pada satu golongan dari atas ke bawah: sifat non logam berkurang. Hal ini disebabkan oleh jari-jari atom bertambah sehingga atom makin sukar menarik elektron untuk membentuk ion negatif.
g. Titik leleh dan titik didih.
- Dalam satu periode unsur kondisi titik cair dan titik didih akan naik dari kiri ke kanan sampai golongan IVA, setelah golongan IVA akan mengalami penurunan yang drastis. Berdasarkan sistem periodik unsur kondisi Titik cair dan titik didih paling rendah dimiliki oleh unsur golongan VIIIA.
- Dalam satu golongan unsur kondisi unsur-unsur pada golongan IA – IVA. Kondisi titik cair dan titik didih semakin rendah dari posisi atas ke bawah; sedangkan unsur-unsur golongan VA – VIIIA ,titik cair dan titik didihnya akan makin tinggi.
MATERI DAN CONTOH SOAL LAINNYA
Rangkuman Materi dan Perubahan Unsur Kimia
Ringkasan Materi Kimia Sistem Periodik Unsur
Ringkasan Materi Perkembangan Teori Model Atom
Rangkuman Materi Bilangan Kuantum
Rangkuman Materi Konfigurasi Elektron
20 Soal dan Kunci Jawaban Struktur Atom
30 Latihan dan Kunci Jawaban Soal Struktur Atom
Latihan Soal Struktur Atom, Sistem Periodik dan Ikatan Kimia |
Ringkasan Materi Kimia Sistem Periodik Unsur
Ringkasan Materi Perkembangan Teori Model Atom
Rangkuman Materi Bilangan Kuantum
Rangkuman Materi Konfigurasi Elektron
20 Soal dan Kunci Jawaban Struktur Atom
30 Latihan dan Kunci Jawaban Soal Struktur Atom
Latihan Soal Struktur Atom, Sistem Periodik dan Ikatan Kimia |






Tidak ada komentar:
Posting Komentar