Guru Vokasi - Ilmu kimia merupakan ilmu yang mempelajari materi seperti susunannya, sifat-sifat, perubahan materi dan energi yang menyertai perubahan dari materi tersebut. sedangkan kata kimia itu sendiri berasal dari bahasa arab yaitu kimiya atau bahasa yunani khemeia yang memiliki arti perubahan benda/zat. Jika diartikan secara luas kimia dapat dimaknai sebagai ilmu tentang komposisi, struktur dan sifat zat suatu materi.
A. Materi
Materi adalah segala sesuatu yang memiliki massa dan menempati ruang (volume). Contohnya manusia, tumbuhan, hewan, buku, dan pensil.Massa menunjukkan jumlah materi yang menyusun suatu benda. Sedangkan volume adalah perhitungan seberapa banyak ruang yang bisa ditempati dalam suatu objek
a. Sifat-sifat Materi
- Sifat fisis adalah sifat yang tidak berhubungan dengan pembentukan zat baru, melainkan berhubungan dengan keadaan fisis suatu zat. Contoh:titik leleh,titik didih,kerapatan, massa jenis, warna,dan bau.
- Sifat kimia adalah sifat yang berhubungan dengan pembentukan zat baru. Contoh: kereaktifan, mudah tidaknya terbakar, dan mudah tidaknya berkarat.
- Sifat ekstensif adalah sifatyang bergantung pada jumlah materi. Contoh: massa,volume,dan entalpi (kandungan energi).
- Sifat intensif adalah sifat yang tidak bergantung pada jumlah zat. Contoh: titik leleh,titik lebur,kalor jenis,bau,dan rasa.
- Perubahan fisis adalah perubahan materi yang tidak menghasilkan zat baru. Contoh: pelelehan lilin, penyubliman kapur barus, pengecatan tembok, pemisahan nitrogen dari udara,dan pencucian pakaian.
- Perubahan kimia adalah perubahan materi yang menghasilkan zat baru. Contoh: pembakaran kertas,fotosintesis, pencernaan makanan, pembusukan makanan, pengelantangan pakaian, dan pembuatan adukan semen.
B. Unsur, Senyawa, dan Campuran
a. Unsur
Unsur adalah materi yang paling sederhana, tidak dapat diuraikan lagi menjadi zat yang lebih sederhana, baik secara fisika maupun dengan reaksi kimia. Contoh: Besi (Fe), karbon (C), dan oksigen (O).
b. Senyawa
Senyawa adalah gabungan dua unsur atau lebih yang berikatan melalui reaksi kimia. Contoh: Air murni (H₂O), glukosa (C₆H₁₂O₆), amoniak (NH₃).
c. Campuran
Campuran adalah kumpulan dua zat atau lebih yeng bergabung tanpa reaksi kimia. Contoh: larutan gula (campuran gula dan air), larutan garam (campuran garam dan air), dan susu (campuran karbohidrat, protein,lemak,dan berbagai vitamin).
C. Partikel-Partikel Materi
a. Atom
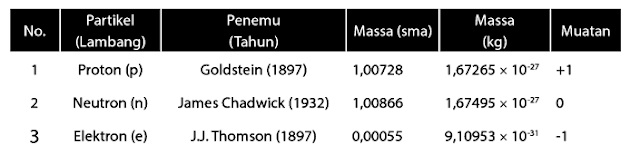
Atom adalah partikel terkecil dari unsur yang masih mempunyai sifat unsur tersebut. Atom-atom suatu unsur memiliki sifat identik, akan tetapi berbeda dengan atom unsur lain. Unsur besi terdiri atas atom-atom besi dan unsur aluminium terdiri atas atom-atom aluminium.Sifat antar atom besiadalah sama tetapiberbeda dengan sifat atom aluminium. Partikel-partikel dasar yang menyusun atom adalah elektron, Inti atom yang terdiri dari proton dan neutron
1. Elektron
elektron merupakan partikel pembentuk atom yang bermuatan negatif. Massa elektron sangat ringan sehingga hampir dianggap tidak bermassa. Besarnya muatan 1 elektron sebesari,6 x 10⁻¹⁹ C.
2. Inti Atom
Merupakan bagian terkecil dari atom dan memiliki massa paling besar. Inti atom terdiri atas:
Proton, yaitu partikel pembentuk atom yang bermuatan positif. Proton dilambangkan dengan huruf p. Besarnya massa 1 proton sebesar 1 sma atau sebanding dengan 1,6 x 10⁻²⁴ gram. Sedangkan muatan 1 proton adalah +1 yang juga sebanding dengan 1,602 .10⁻¹⁹ Coulomb.
Neutron, yaitu partikel pembentuk atom yang bermuatan netral (tidak memiliki muatan). Massa
neutron hampir sama dengan proton, yaitu sebesar 1 sma. Untuk Rincian dari Proton, elektron Neutron dapat dilihat pada tabel berikut ini:
b. Molekul
Molekul adalah gabungan dari dua atom atau lebih yang berikatan secara kimia. Molekul dibedakan menjadi dua, yaitu molekul unsur dan molekul senyawa. Disebut molekul unsur, jika atom-atom yang berikatan sejenis, contoh: oksigen (O₂), nitrogen (N₂), dan klor (Cℓ₂). Disebut molekul senyawa, jika atom-atom yang berikatan berbeda jenis, contoh: air (H₂O),amoniak (NH₃), dan urea(CO(NH)₂)₂).
Dalam penulisan unsur terdapat aturan yang telah disepakati bersama, yang dinamakan lambang unsur, berikut ini adalah aturan yang digunakan untuk penulisan lambang unsur
ªₓX
dengan keternagan nya adalah sebagai berikut ini:
X = Lambang unsur/atom
a = Nomor massa atom (jumlah proton + jumlah neutron
z = Nomor atom = jumlah proton = jumlah elektron (untuk atom atau unsur netral)
a-z = Jumlah neutron
Contoh:
Tentukan jumlah proton, elektron, dan neutron untuk unsur di bawah ini!
1. ⁷₃Li
Nomor massa = 7
Nomor atom = 3
Σ p = Σ e = nomor atom = 3
Σ n = nomor massa - nomor atom
= 7- 3 = 4
2. ³¹₁₅ P
Nomor massa = 31
Nomor atom = 15
Σ p = Σ e = nomor atom = 15
Σ n = nomor massa - nomor atom
= 31-15 = 16
c. Ion
Ion adalah atom atau molekul yang bermuatan listrik. Ion dibedakan menjadi dua, yaitu ion positif (kation) dan ion negatif (anion).
- Kation Contoh: ion natrium (Na⁺), ion kalium (K⁺), dan ion amonium (NH₄⁺).
- Anion Contoh: ion klorida (Cℓ⁻), ion nitrat (N0₃⁻ ), dan ion sulfat (SO₄²⁻ ).
- Senyawa ion Contoh: natrium klorida (NaCℓ), kalium nitrat (KNO₃), dan amonium sulfat ((NH₄)₂SO₄).
MATERI DAN CONTOH SOAL LAINNYA
Rangkuman Materi dan Perubahan Unsur Kimia
Ringkasan Materi Kimia Sistem Periodik Unsur
Ringkasan Materi Perkembangan Teori Model Atom
Rangkuman Materi Bilangan Kuantum
Rangkuman Materi Konfigurasi Elektron
20 Soal dan Kunci Jawaban Struktur Atom
30 Latihan dan Kunci Jawaban Soal Struktur Atom
Latihan Soal Struktur Atom, Sistem Periodik dan Ikatan Kimia |
Ringkasan Materi Kimia Sistem Periodik Unsur
Ringkasan Materi Perkembangan Teori Model Atom
Rangkuman Materi Bilangan Kuantum
Rangkuman Materi Konfigurasi Elektron
20 Soal dan Kunci Jawaban Struktur Atom
30 Latihan dan Kunci Jawaban Soal Struktur Atom
Latihan Soal Struktur Atom, Sistem Periodik dan Ikatan Kimia |







Tidak ada komentar:
Posting Komentar